AbstractPurpose:Currently, cardiac troponins T and I remain the best biomarkers in acute coronary syndromefor both diagnosis and risk assessment. Heart-type fatty acid-binding protein (H-FABP) has been recentlydeveloped as an early cardiac biomarker. The aim of this study was to evaluate the performance of anH-FABP reagent (Randox Laboratories, Crumlin, United Kingdom), which is an automated immunoturbidimetryassay for the quantitative determination of H-FABP, and establish reference limits in the generalKorean population.
Methods:The H-FABP reagent was evaluated for its precision, linearity, limits, carryover and interferencefollowing the Clinical and Laboratory Standards Institute guidelines. In addition, the reference limitsof H-FABP were established in 130 men and 129 women.
Results:The within-run, between-run, between-day and total coefficient of variation for H-FABP assaywere 5.74%, 3.30%, 5.08%, and 8.35% at the low level, respectively, and 2.07%, 2.39%, 2.98%, and 4.35%at the high level. Linearity was achieved in the range of 1.03-139.06 ng/mL with the high coefficient of determination(R2) of 0.9969. No specific interferences were observed in a high concentration sample. Theupper limits of the reference ranges were 8.42 ng/mL and 10.48 ng/mL in men and women, respectively.
Conclusion:The H-FABP immune-turbidimetric assay for the measurement of H-FABP in serum showedexcellent precision and linearity. Using this assay with an automated chemistry analyzer and the referencelimits established in the Korean population were considered useful for the carrying out of this assayin Korea.
서론통상적으로 심혈관 질환의 진단을 위해서 심전도, 흉부X선, 심초음파, 심도자, 심단층촬영, 바이오마커 등이 사용된다. 그중에서도 바이오마커는 진단의 정확성을 향상시키고 환자의 위험층화(risk stratification) 및 예후를 알아보는 데 중요한 역할을 한다. 특히, 치료방법의 발달에 따라서 초기에 심근경색을 진단할 수 있는 바이오마커를 제공하는 것이 중요하게 되었다[1-3].
심장형지방산결합단백(heart type-fatty acid binding protein, H-FABP)은 세포질에 존재하는 15 kDa의 작은 단백질로서 지방산대사에 관여한다. H-FABP에 의하여 세포막으로부터 미토콘드리아로 운반된 긴사슬지방산은 그곳에서 산화된다. H-FABP는 작고 잘 녹는 성질로 인해 심근세포 손상 시 심근세포에서 혈액으로 빠르게 유리되어 급성심근경색의 초기 표지자로 알려져 왔다[4,5]. 또한 최근에는 H-FABP가 급성관상동맥증후군 환자들의 예후에도 역할을 할 수 있다고 보고되었다[6,7].
H-FABP를 측정하기 위하여 효소면역측정법, 전류효소면역센서(amperometric enzyme immunosensor), 면역혼탁측정법, 형광측정법, 면역크로마토그래피 검사 등의 다양한 방법들이 개발되었다[8]. 그중에서도 Randox사에서 개발한 면역혼탁측정법을 이용한 H-FABP 측정시약은 완전 자동화가 가능하며 결과를 얻기까지 14분의 시간이 소요되고 혈청과 혈장 검체로 검사가 가능하다. 이 연구에서는 Randox사의 면역혼탁측정법을 이용한 H-FABP 시약의 수행능을 평가하고 추가적으로 한국 성인남녀의 참고치를 설정하였다.
방법H-FABP를 측정하기 위해서 면역혼탁측정법을 이용하는 H-FABP (Randox Laboratories, Crumlin, United Kingdom) 시약과 Hitachi 7600-010 (Hitachi, Tokyo, Japan) 화학검사 장비를 사용하였다. 혈청검체 8 μL와 완충액(R1) 160 μL, H-FABP 항체가 코팅된 라텍스(R2) 40 μL를 반응시키고 700 nm 파장의 빛으로 투과도의 감소를 측정하였다. Clinical and Laboratory Standards Institute (CLSI) 지침에 따라 정밀도, 직선성, 회수율, 검출한계, 검체 간 교차오염률, 간섭물질을 평가하였다. 또한, 한국인 성인남녀에서 H-FABP의 참고치를 구하였다.
정밀도제조사에서 제공하는 정도관리 물질, Randox H-FABP Control Level 1 (저농도), 2 (고농도)를 사용하여 CLSI EP5-A2 지침[9]에 따라 평가하였다. 20일 동안 1일 2회씩 매 검사마다 2회 반복 측정하였으며 하루 2회 검사는 오전과 오후로 나누어 실시하였다. 측정된 결과로 수행 내 정밀도(반복 정밀도), 수행 간 정밀도, 수행일 간 정밀도, 분석기기 내 정밀도(총 정밀도)를 구하였다.
직선성직선성은 CLSI EP6-A 지침[10]에 따라 고농도(139.06 ng/mL)와 저농도(1.03 ng/mL)의 환자검체를 5단계로 희석하여 마련한 물질을 평가하였다. 5가지 농도 물질은 고농도와 저농도의 검체를 각각 4:0, 3:1, 2:2, 1:3, 0:4의 비로 혼합하여 마련하였다. 각 농도의 물질당 2회 반복 측정하여 측정된 결과로 다항회귀분석(polynomial regression analysis)을 시행하여 최적의 다항식을 구하였다. 최적의 다항식이 일차 선형인 경우 해당 범위의 직선성이 유지되는 것으로 판정하였으며 일차 선형이 아닌 경우 상대적 비직선성이 2.5% 이하를 만족하면 직선성이 있다고 판정하였다.
회수율정확도를 보기 위해 회수율을 평가하였다. 직선성 평가에 사용된 농도 물질을 이용하여 각각 2회 측정하였으며 직선성을 유지하는 농도의 기대치에 대한 실측치의 백분율을 산출하였다.
검출한계검출한계는 CLSI EP17-A 지침[11]에 따라 실시하였다. 우선, 영점대조 한계(Limit of blank, LoB)는 공백 검체 즉, 다섯 개의 증류수 검체를 12회 반복측정하여, 총 60개의 결과값의 95th 백분위수값으로 자체 설정하였다. 검출한계(Limit of detection, LoD)는 LoB와 LoB 4배 농도 사이의 저농도 검체 5개를 사용하여 각 12회 총 60회 측정하였으며 자료가 정규분포를 따르지 않았기에 비모수적 분포 측정을 이용하여 관련되는 식(LoD = LoB+Ds,β)으로 계산하였다. Ds,β는 중앙값에서 측정값의 β 백분위수까지의 차이를 의미하며 β는 5로 설정하였다. 정량한계(limit of quantitation, LoQ)는 제조사에서 제공한 LoQ값(3.49 ng/mL)을 검증하였으며 위 농도의 검체를 30회 반복 측정하여 총 오차 목표인 20% 이내(2.79-4.19 ng/mL)에 드는 결과의 개수가 87% 이상이면 검증을 완료하였다.
검체 간 교차오염률검체 간 교차오염률(carry-over rate)은 고농도(91.36 ng/mL)와 저농도(2.01 ng/mL)의 환자 검체를 사용하였다. 고농도 환자 검체를 4회 연속 측정한 뒤 연속하여 저농도 환자검체를 4회 측정하였고 해당하는 공식 {L1-(L3+L4)/2}×100/{(H2+H3)/2-(L3+L4)/2}에 따라 교차오염률(%)을 계산하였다.
간섭물질(Interference)H-FABP 농도가 각각 2.11 ng/mL, 38.67 ng/mL인 혼합혈청을 사용하였다. 불포합빌리루빈, 포합빌리루빈, 혈색소, 지질을 각각 5단계로 희석하여 포합 및 불포합빌리루빈은 4-20 mg/dL, 혈색소는 100-500 mg/dL, 지질은 144-719 mg/dL의 농도로 만들어 각 혼합혈청과 섞은 후 각 농도 물질당 2회 반복 측정하였으며 간섭물질이 섞이지 않은 혼합혈청도 매번 2회 반복 측정하였다. 측정값이 평균 혼합혈청 농도에 비해 10% 이상 차이가 나면 의미있는 간섭현상이 있는 것으로 판단하였다.
참고치 설정종합검진을 위하여 내원한 20세 이상의 건강한 성인 남녀 중 혈중 트로포닌 T (참고치 < 0.1 ng/mL), 크레아티닌 (참고치 0.5-1.2 mg/dL), 공식(modification of diet in renal disease, MDRD)을 사용한 추정사구체여과율(estimated glomerular filtration rate, eGFR)이 정상(참고치 > 60 mL/min/1.73 m2)인 남자 130명, 여자 129명의 H-FABP 측정값을 분석하여 CLSI C28-A3 지침[12]에 따라 참고치를 설정하였다.
결과정밀도정밀도 평가 결과, Level 1과 Level 2의 평균 농도는 4.85 ng/mL, 33.27 ng/mL이었다. 수행 내 정밀도는 각각 5.74%, 2.07%이었고 총 정밀도는 8.35%, 4.35%이었다(Table 1).
직선성평가 결과 최적의 다항식이 일차선형이었고 결정계수(coefficient of determination, R2)는 0.9969였으며 임상적으로 유용한 측정범위인 1.03-139.06 ng/mL에서 우수한 직선성을 나타내었다(Fig. 1).
검출한계영점대조한계는 0.91 ng/mL였고 검출한계는 1.63 ng/mL였다. 정량 한계는 제조사가 제공한 정량 한계값인 3.49 ng/mL 농도의 검체를 30회 반복 측정한 결과 총 오차 목표 이내에 드는 결과가 93.3%로 87% 이상이었으므로 검증을 완료하였다.
간섭물질불포합빌리루빈농도 20 mg/dL까지 간섭현상이 없었고 포합빌리루빈은 저농도 검체는 16 mg/dL, 고농도 검체는 20 mg/dL까지 간섭 현상이 없었다. 혈색소는 고농도 검체의 경우 500 mg/dL까지는 간섭현상이 없음을 확인하였고 저농도 검체는 간섭물질이 없는 혈청 검체에 비해 200 mg/dL에서 -10.8%, 500 mg/dL에서 -11.1%의 차이를 보였다. 중성지방은 719 mg/dL까지 간섭현상이 없었다(Table 2).
참고치 설정참고치 설정을 위한 대상자들의 나이는 남자 20-80세(평균 47.0세), 여자 20-85세(평균 45.9세)였다. H-FABP 농도는 남자가 평균 2.89 ng/mL, 표준편차 1.35 ng/mL, 중앙값 2.61 ng/mL, 사분위수 범위 2.10-3.17 ng/mL였고 여자는 평균 3.40 ng/mL, 표준편차 1.90 ng/mL, 중앙값 2.79 ng/mL, 사분위수 범위 2.24-4.07 ng/mL였으며 남녀 간 차이가 있었다(Fig. 2, Table 3, P<0.05). 정규분포를 이루지 않아 비모수적 방법을 사용하여 분석하였다. 95 백분위수를 기준으로 한 참고치는 남성 ≤ 5.19 ng/mL, 여성 ≤ 7.16 ng/mL이었고, 99 백분위수를 기준으로 한 참고치는 남녀 각각 ≤ 8.42 ng/mL, ≤10.48 ng/mL였다.
고찰현재까지 급성심근경색을 신속하고 정확하게 진단하기 위해서 혈청학적 검사로서 미오글로빈과 심장트로포닌이 주로 사용되고 있다. 심장트로포닌은 심근경색 진단에 있어서 특이적인 진단능을 제공하지만 심근경색 4-6시간 후 혈액으로 나오기 때문에 조기 진단에는 한계가 있다[8]. 심근경색의 조기 표지자로 미오글로빈이 사용되는 가운데 1988년 H-FABP가 조기 표지자로 처음 소개가 되었다[13]. 이후 여러 연구들에 의하면 H-FABP의 민감도가 대체적으로 미오글로빈보다 높은 것으로 보고되었다[14-16]. H-FABP는 심근세포의 손상 후 2-3시간에 증가하고 12-24시간 내에 다시 감소하는 것으로 알려져 있다[17,18]. 또한 H-FABP가 급성심근경색 진단을 위해 민감도가 높은 표지자라는 최근의 연구결과들은 그러한 사실을 뒷받침한다[14-16,19,20].
저자들은 임상검사실에서 사용하기 위해 개발된 면역혼탁법을 이용한 H-FABP (Randox Laboratories) 검사시약의 수행능을 평가하였다. 두 가지 농도의 물질을 이용하여 시행한 검사결과를 통해서 총 변이계수가 모두 10% 이하로 양호한 정밀도를 보여 주었고, 임상적으로 의미 있는 농도 1.03-139.06 ng/dL에서 최적의 다항식이 일차선형으로 우수한 직선성을 보임을 알 수 있었다. 직선성을 보인 구간은 제조사에서 제공한 측정가능 범위(0.747-120 ng/mL)를 포함하였다. 직선성을 보이는 농도에서 회수율은 94-105%로 나타나 검사의 정확성을 확인할 수 있었다. 직접 측정한 영점 대조한계값(0.905 ng/mL)은 제조사에서 제공한 값(0.747 ng/mL)보다 다소 높은 값을 보였으며 검사의 검출 한계농도(LoD)는 1.625 ng/mL였다. 정량한계값(LoQ)은 제조사에서 제공한 값(3.49 ng/mL)을 검증하였으며, 이는 참고치에 비해 충분히 낮았다.
H-FABP 고농도(38.67 ng/mL) 혼합혈청에서는 빌리루빈, 혈색소, 중성지방 등의 간섭현상이 보이지 않았으나 저농도(2.11 ng/mL) H-FABP 혼합혈청은 고농도의 포합빌리루빈(20 mg/dL)에서 2.42 ng/mL 측정되어 15.6%의 차이를 보였다. 이는 저농도 혼합혈청이 정량한계값보다 낮아서 의미가 없는 것으로 생각된다.
이번 연구에서 남녀 간의 H-FABP 농도의 의미 있는 차이는 근육량이 많은 남자가 여자에 비해 H-FABP 수치가 높다는 이전의 보고[21]와는 상반되었다. 동일한 제조사의 시약을 사용한 다른 보고에서는 301명을 대상으로 하여 성별에 따른 차이는 없었고 99 백분위수값이 9.10 ng/mL로 이번 연구의 결과(남녀 259명, 99 백분위수 9.18 ng/mL)와 유사하였다[22].
결론적으로 H-FABP (Randox Laboratories) 검사 시약은 비교적 우수한 정밀도와 직선성을 보여 주었고, 자동화학 분석기를 통해서 빠르게 검사가 가능하였다. 또한 한국인을 대상으로 하여 구한 참고치는 향후 이 검사를 시행하는 데 있어서 도움이 될 것으로 생각된다.
Fig. 2.Distributions of heart-type fatty acid-binding protein (H-FABP) concentrations in healthy men (A) and women (B). 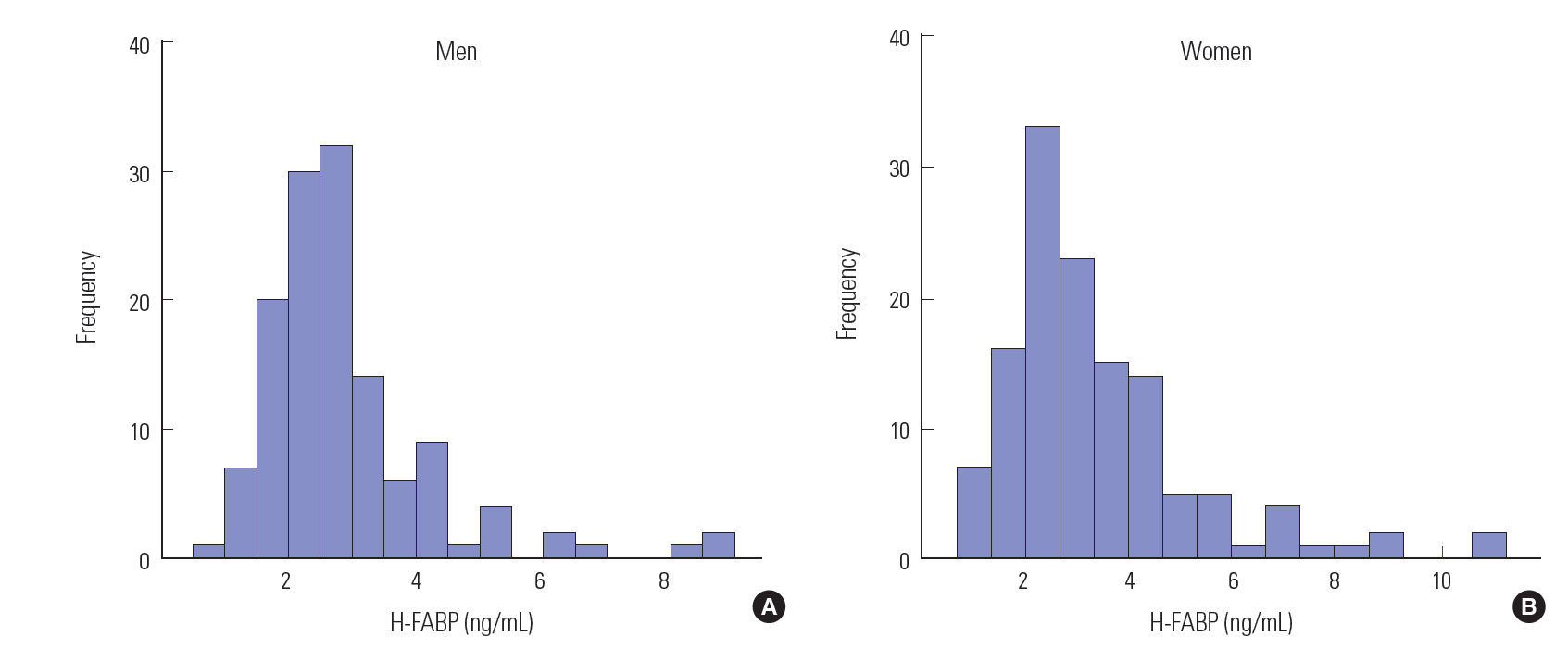
Table 1.Precision of the H-FABP immunoturbidimetry assay
Table 2.Interferences of unconjugated bilirubin, conjugated bilirubin, hemoglobin and triglyceride with H-FABP determination Table 3.H-FABP values in the general population with normal troponin T, creatinine, and eGFR
References1. Hamilton AJ, Swales LA, Neill J, Murphy JC, Darragh KM, Rocke LG, et al. Risk stratification of chest pain patients in the emergency department by a nurse utilizing a point of care protocol. Eur J Emerg Med 2008;15:9-15.
2. Newby LK, Storrow AB, Gibler WB, Garvey JL, Tucker JF, Kaplan AL, et al. Bedside multimarker testing for risk stratification in chest pain units: The chest pain evaluation by creatine kinase-MB, myoglobin, and troponin I (CHECKMATE) study. Circulation 2001;103:1832-7.
3. Apple FS, Christenson RH, Valdes R Jr, Andriak AJ, Berg A, Duh SH, et al. Simultaneous rapid measurement of whole blood myoglobin, creatine kinase MB, and cardiac troponin I by the triage cardiac panel for detection of myocardial infarction. Clin Chem 1999;45:199-205.
4. McCann CJ, Glover BM, Menown IBA, Moore MJ, McEneny J, Owens CG, et al. Novel biomarkers in early diagnosis of acute myocardial infarction compared with cardiac troponin T. Eur Heart J 2008;29:2843-50.
5. Reiter M, Twerenbold R, Reichlin T, Mueller M, Hoeller R, Moehring B, et al. Heart-type fatty acid-binding protein in the early diagnosis of acute myocardial infarction. Heart 2013;99:708-14.
6. Kilcullen N, Viswanathan K, Das R, Morrell C, Farrin A, Barth JH, et al. Heart-type fatty acid-binding protein predicts long-term mortality after acute coronary syndrome and identifies high-risk patients across the range of troponin values. J Am Coll Cardiol 2007;50:2061-7.
7. Viswanathan K, Kilcullen N, Morrell C, Thistlethwaite SJ, Sivananthan MU, Hassan TB, et al. Heart-type fatty acid-binding protein predicts long-term mortality and re-infarction in consecutive patients with suspected acute coronary syndrome who are troponin-negative. J Am Coll Cardiol 2010;55:2590-8.
8. Kakoti A, Goswami P. Heart type fatty acid binding protein: structure, function and biosensing applications for early detection of myocardial infarction. Biosens Bioelectron 2013;43:400-11.
9. CLSI. Evaluation of precision performance of quantitative measurement methods; Approved guideline-Second edition. CLSI document EP5-A2 Wayne, PA, USA: Clinical and Laboratory Standards Institute;2004.
10. CLSI. Evaluation of the linearity of quantitative measurement procedures: A statistical approach; Approved guideline. CLSI document EP6-A Wayne, PA, USA: Clinical and Laboratory Standards Institute;2003.
11. CLSI. Protocols for determination of limits of detection and limits of quantitation; Approved guideline. CLSI document EP17-A Wayne, PA, USA: Clinical and Laboratory Standards Institute;2004.
12. CLSI. Defining, establishing, and verifying reference intervals in the clinical laboratory; Approved guideline-Third edition. CLSI document C28-A3 Wayne, PA, USA: Clinical and Laboratory Standards Institute;2008.
13. Glatz JF, van Bilsen M, Paulussen RJ, Veerkamp JH, van der Vusse, Reneman RS. Release of fatty acidbinding protein from isolated rat heart subjected to ischemia and reperfusion or to the calcium paradox. Biochim Biophys Acta 1988;961:148-52.
14. Seino Y, Ogata K, Takano T, Ishii J, Hishida H, Morita H, et al. Use of a whole blood rapid panel test for heart-type fatty acid-binding protein in patients with acute chest pain: comparison with rapid troponin T and myoglobin tests. Am J Med 2003;115:185-90.
15. Okamoto F, Sohmiya K, Ohkaru Y, Kawamura K, Asayama K, Kimura H, et al. Human heart-type cytoplasmic fatty acid-binding protein (H-FABP) for the diagnosis of acute myocardial infarction. Clinical evaluation of H-FABP in comparison with myoglobin and creatine kinase isoenzyme MB. Clin Chem Lab Med 2000;38:231-8.
16. Body R, McDowell G, Carley S, Wibberley C, Ferguson J, Mackway-Jones K. A FABP-ulous ‘rule out’ strategy? Heart fatty acid binding protein and troponin for rapid exclusion of acute myocardial infarction. Resuscitation 2011;82:1041-6.
17. Tanaka T, Hirota Y, Sohmiya K, Nishimura S, Kawamura K. Serum and urinary human heart fatty acid-binding protein in acute myocardial infarction. Clin Biochem 1991;24:195-201.
18. Kleine AH, Glatz JF, Van Nieuwenhoven FA, Van der Vusse. Release of heart fatty acid-binding protein into plasma after acute myocardial infarction in man. Mol Cell Biochem 1992;116:155-62.
19. Nakata T, Hashimoto A, Hase M, Tsuchihashi K, Shimamoto K. Human heart-type fatty acid-binding protein as an early diagnostic and prognostic marker in acute coronary syndrome. Cardiology 2003;99:96-104.
20. Glatz JF, van der Vusse, Simoons ML, Kragten JA, van Dieijen-Visser MP, Hermens WT. Fatty acid-binding protein and the early detection of acute myocardial infarction. Clin Chim Acta 1998;272:87-92.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||