서론
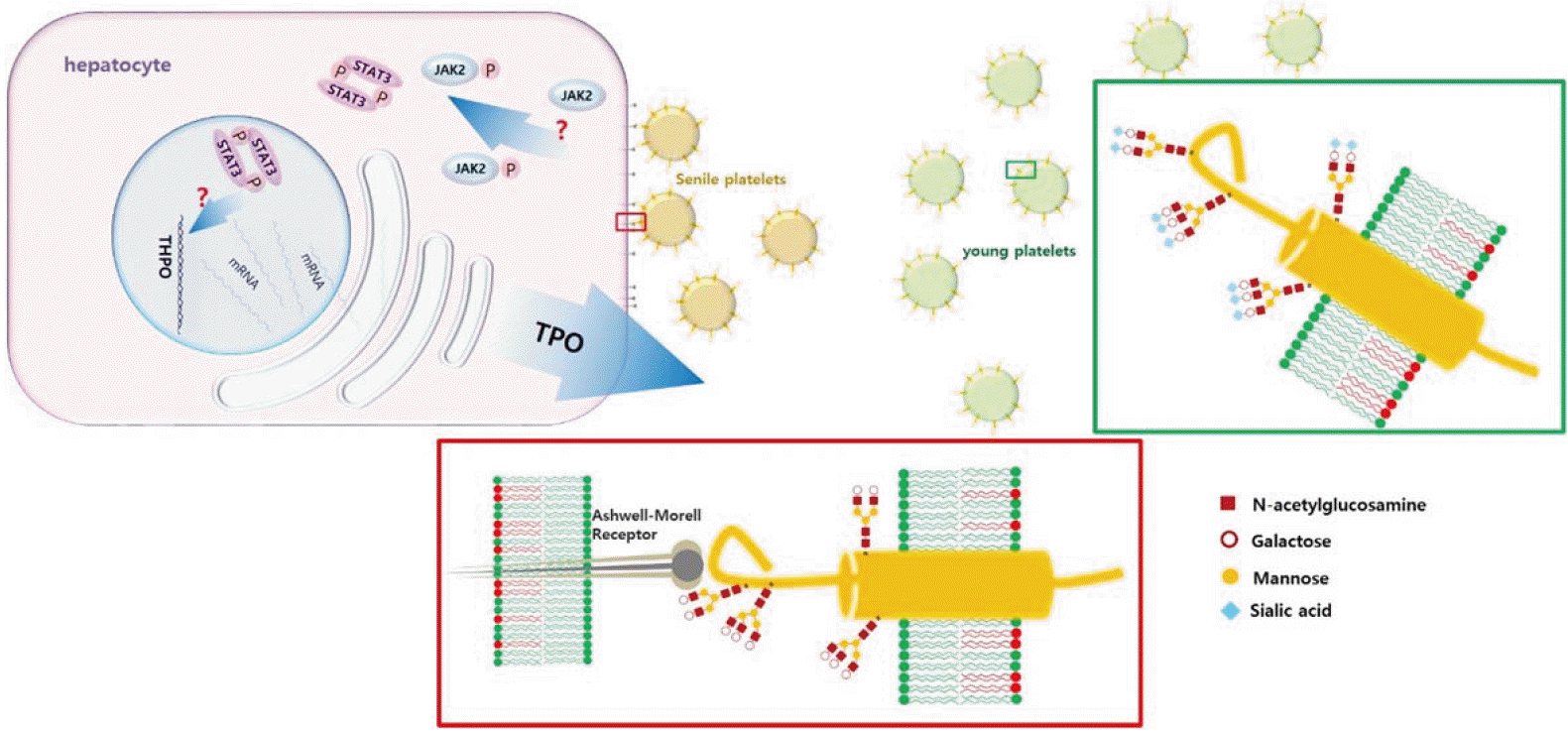
트롬보포이에틴(thrombopoietin, TPO)은 거대핵세포(megakaryocyte) 및 혈소판 조혈작용을 조절하는 주요 성장인자로서 간세포(hepatocyte)에서 주로 합성되고 분비된다[1,2]. 간세포는 말초혈액 혈소판 수에 영향을 받지 않고 일정하게 TPO를 발현하기 때문에, 혈액 및 조직의 유리 TPO 농도는 혈소판과 거대핵세포 표면의 TPO 수용체(c-mpl)에 결합되고 남은 양에 의해 결정되는 것으로 알려져 있다[3-5]. 하지만 이러한 수동적 조절 기전만으로 TPO 농도 변화를 모두 설명할 수는 없는데, 염증이 동반된 다양한 임상 조건에서 인터루킨 6 (IL-6)에 의해 TPO 농도가 증가되는 것은 잘 알려져 있고[6], 특발저혈소판자색반병(idiopathic thrombocytopenic purpura, ITP) 환자의 TPO 농도는 혈소판수로부터 예상할 수 있는 것보다 더 낮아져 있다[7,8]. 또한 NF-E2 녹아웃 생쥐는 저혈소판증을 보이나 TPO 농도는 정상이고 반면[9], Bak 또는 Bax 녹아웃 생쥐는 혈소판증가증을 보이나 TPO는 증가되어 있다[10]. 이는 TPO 농도를 결정하는 다른 기전이 있음을 나타내는 소견들이지만 이런 기전에 대해서는 연구되거나 알려진 바가 별로 없다. 최근 시알산(sialic acid)이 제거된 혈소판 표면 당단백이 간세포의 Ashwell-Morell 수용체와 결합함으로써 TPO 발현을 증가시킴이 보고되었기에 관련 연구 결과를 간단히 소개하고자 한다[11].
혈소판 당단백의 시알화(sialylation of platelet glycoproteins)
시알산은 9탄당인 뉴라민산(neuraminic acid)의 다양한 유도체로서 흔히 당단백이나 글리코스핑고리피드(glycosphingolipid)의 당쇄(glycan chain) 말단에 위치한다[12]. 타액 당단백인 점액소(mucin)에 특히 많이 함유되어 있으며 세포 표면의 당단백도 다양한 정도로 시알화되어 있다[12]. 혈소판의 주요 막 당단백인 GPIbα도 점액소양(mucin type) O-글리칸(glycan)으로 촘촘히 당화되어 있어 시알산을 많이 표현함을 예상할 수 있다[13]. 혈소판 표면의 시알산은 시알분해효소(sialidase), 뉴라민분해효소, neuraminidase)로 처리하여 인위적으로 제거할 수 있는데[12], 패혈증과 같이 혈소판이 세균에 직접 노출되는 경우 세균 유래 시알분해효소에 의해 시알산이 제거되기도 한다[14,15]. 또한 자연적인 소실로 인해 혈액 내 노화 혈소판은 시알산 함량이 낮으며, 분리한 혈소판을 냉장 보관할 경우 혈소판 자체의 시알분해효소가 유리되어 표면 시알산의 제거가 촉진된다[16,17]. 시알산이 떨어져나가 그 근위부 당쇄 구조(Galβ1-4GlcNAc-, Galβ1-3GlcNAc-)가 노출되면 Ashwell-Morell 수용체와의 결합을 통해 혈소판이 간에서 제거된다[16-18]. 이러한 기전은 냉장 보관한 혈소판을 수혈할 때 체내 혈소판 회복률이 현저하게 떨어지는 현상을 일부 설명할 수 있다. 간 대식세포(Kupffer cell)의 αMβ2 인테그린(integrin) 수용체인 Mac-1도 GPIbα의 시알산 제거로 노출된 β-N-acetlylglucosamine (β-GlcNAc)과 결합하여 냉장 혈소판을 혈액으로부터 제거하는 역할을 한다[16-19]. 혈소판 외에도 혈전지혈 관련 당단백인 von Willebrand 인자(VWF)의 당쇄 시알산이 결핍될 경우 그 체내 제거율이 증가되는 사실이 보고되기도 하였다[20]. 이 연구에서도 시알산 결핍 생쥐의 혈소판이 감소된 사실을 관찰하였으나 이를 시알산 결핍에 의한 VWF의 기능적 변화, 즉 혈소판 결합 친화력 증가로 혈소판에 더 많이 부착된 VWF이 혈소판과 함께 제거되기 때문인 것으로 설명하였다. Ashwell-Morell 수용체는 C형 렉틴 군(C-type lectin family)에 속하는 렉틴으로서 이전 명칭인 asialoglycoprotein receptor (ASGPR)로 불리기도 한다. Hepatic lectin-1/asialoglycoprotein-1 (HL-1/asgr-1)과 hepatic lectin-2/asialoglycoprotein-2 (HL-2/asgr-2)의 두 막 당단백으로 구성된 소중합체 구조를 이루며, 관련 유전자는 서로 다르지만 밀접하게 연관되어 있다[14]. 혈소판과의 반응을 위해선 asgr-1과 asgr-2가 모두 필요하지만 VWF과의 결합에는 주로 asgr-1이 작용한다[15]. 간 외의 다른 조직에서도 발견되지만 주로 간에서 발현되며 간세포의 마커로 사용되기도 한다[14]. Ashwell-Morell 수용체는 당단백의 당 말단 부위를 인식하여 결합하고 세포내이입(endocytosis)을 매개하며, 해로운 당단백으로부터 신체를 보호하는 역할을 하는 것으로 알려져 있다[14]. 예를 들어 패혈증은 체내 시알화 상태에 큰 변화를 가져올 수 있는데 Ashwell-Morell 수용체는 폐렴구균 패혈증에 따른 소모성 응고병증에 대해 방어 효과가 있는 것으로 알려져 있다[15,21].
Ashwell-Morell 수용체와 트롬보포이에틴(the Ashwell-Morell receptor and thrombopoietin)
Ashwell-Morell 수용체에 의해 이입된 혈소판이 간세포에 미치는 영향에 대한 첫 발견으로서 TPO 발현을 증가시키는 사실이 최근 알려지게 되었다. 주요 연구 기법은 시알산 결핍 혈소판을 조혈 또는 조작하여 생쥐에 수혈하거나 간세포주(HepG2)와 함께 배양하여 세포의 반응을 관찰하는 것이다. Asgr2-/- 및 St3gal4-/- 두 종류의 녹아웃 생쥐에서 시알산 결핍 혈소판이 증가되는데, St3gal4-/- 생쥐는 주요 시알산전이효소 기능이 없기 때문에 시알산과 관련된 다른 연구에도 흔히 사용되어 왔다. Asgr2-/- 생쥐는 Ashwell-Morell 수용체 기능에 대한 직접적인 단서를 제공하는 것 외에도, 시알기를 잃은 노화 혈소판이 간에서 제거되지 않고 혈액 내에 축적되기 때문에 St3gal4-/-처럼 시알산 결핍 혈소판의 제공원으로 사용될 수 있다. 두 생쥐의 혈소판을 채취하여 자연형 생쥐에 수혈하면 간 조직의 TPO 유전자 발현과 생합성 및 혈액내 TPO 농도가 증가하고 이에 따라 골수 내 거대핵세포가 증식하고 말초혈액 혈소판 수가 증가한다. 반면 Asgr2-/- 생쥐는 같은 혈소판을 수혈해도 TPO 발현이 변하지 않는다. 이는 Ashwell-Morell 수용체가 TPO 발현을 매개함을 의미하는데, 이 과정에 Ashwell-Morell 수용체와 연관돼 있는 인산화효소(kinase) 중 하나인 Janus kinse 2 (JAK2)와 이하 signal transduction and activation of transcription 3 (STAT3) 신호전달 체계가 작용한다. 시알산 결핍 혈소판을 수혈하면 간 조직의 JAK2와 STAT3이 선택적으로 인산화되며 JAK2 억제제 (AZD1480, TG101348)를 투여하면 혈소판에 의한 간 조직이나 혈액의 TPO 증가 반응이 소실된다. 요약하자면, 시알산 결핍 혈소판이 Ashwell-Morell 수용체의 작용에 의해 간에서 제거됨으로써 간 조직에서 TPO 발현을 증가시키며 이는 JAK2/STAT3 경로에 의존한다. 간 조직은 간세포 외에 대식세포나 내피세포 또는 간엽세포 등을 포함하고 있으며 TPO 발현에 간세포 외의 세포가 결정적 역할을 할 가능성을 배제할 수 없다. 또한 수혈에 사용된 Asgr2-/- 및 St3gal4-/- 생쥐의 혈소판풍부혈장은 혈소판 외에도 많은 시알산 결핍 당단백을 포함하고 있기 때문에 혈소판풍부혈장의 수혈에 의한 간 조직에서의 TPO 발현 증가가 혈소판의 역할에 의한 것인지 아니면 혈장 내 다른 당단백의 작용에 의한 것인지 감별이 필요하다. 해당 연구는 두 추가 실험을 통해 TPO 발현 증가가 간세포와 혈소판 간의 작용에 의한 변화임을 증명하였다. 첫 번째 실험에서는 간세포 유래 HepG2 세포주를 시알산 제거 혈소판과 함께 배양하여 간 조직에서 관찰한 변화를 간세포에서 재현하였다. 정상 혈소판에 비해 시알산 결핍 혈소판들이 간세포에 더 많이 부착되며, 간세포의 TPO 유전자 발현과 생합성 및 배양액으로의 분비가 증가되는데 이 모든 변화는 ASGR2 siRNA 또는 JAK2 억제제에 의해 소실되었다. 그러므로 간 조직에서의 TPO 발현 증가는 주로 간세포에 의한 작용임을 확인할 수가 있다. 두 번째 실험에서는 혈장 성분을 제거한 부유 혈소판을 만들어 생쥐에 투여 하였다. 앞서 언급한 바와 같이 혈소판을 시알분해효소와 반응시키면 혈소판 표면의 시알산을 제거할 수 있다. 시알산 제거 혈소판 부유액을 혈소판풍부혈장 대신 투여하여도 간 조직에서 TPO와 관련된 동일한 변화와 골수 거핵세포의 증식을 관찰할 수 있다. 그러므로 시알산 결핍 혈소판, 간세포 Ashwell-Morell 수용체, JAK2/STAT3 신호전달 및 TPO 발현의 새로운 조절 기전 및 경로가 실험적으로 증명되었다(Fig. 1). 흥미롭게도 시알산분해효소를 혈액에 직접 투여해도 혈소판 수의 감소 이후 간조직의 TPO 발현과 혈중 농도 증가 및 골수내 거대핵세포 증식을 재현할 수 있었다. ITP와 같이 비장에 의해 혈소판이 제거되는 경우는 TPO의 발현이 변하지 않았다.
시알화와 혈전지혈(sialylation and thrombosis and hemostasis)
이와 같이 혈소판 수나 숙주 방어에 더해 혈소판 시알화의 생병리적 기능으로 간세포의 TPO 발현 조절 기전이 더해지게 되었다. 동일한 조절 기전이 인체에서도 작용을 하는지는 추가 연구를 통해 밝혀져야 할 것이다. 하지만 직접적인 임상 관련성을 떠나 이 연구 및 다른 관련 연구들은, 혈소판과 관련된 질환들을 이해함에 있어 혈소판 수나 혈소판 단백의 일차구조 또는 유전 다형성 외에 당쇄 구조의 변화와 같은 또 다른 차원의 요인들을 고려해야 할 필요성을 제시하고 있다. 혈소판 단백을 포함한 모든 당단백들은 당단백 당쇄 부위의 변화로 인해 기능적 다양성을 갖게 된다. 예를 들어 앞서 기술한 바와 같이 VWF의 시알기가 제거될 경우 혈액 내 제거율이 증가될 뿐만 아니라 기능적으로는 혈소판 VWF 수용체인 GPIbα와의 결합 친화력이 증가한다[20]. 그렇다면 알려진 바는 없지만 Asgr1-/-, St3gal4-/-와 같이 시알기가 결핍된 VWF는 Ashwell-Morell 수용체 기능이 없는 체내 환경에서 어떠한 기능적 변화를 보일 것인가? 혈소판 결합 친화력이 증가된 시알산 결핍 VWF가 혈액으로부터 제거되지 않기 때문에 혈전성향을 띠게 될지 아니면 노화되고 표면 GPIbα도 떨어져 나가 기능이 저하된 혈소판이 증가하기 때문에 VWF의 활성이 중화되거나 오히려 출혈성향을 띠게 될 것인가? Ashwell-Morell 수용체와 TPO 발현에 대한 이번 연구는 혈소판이나 혈전지혈 기능 당단백의 당쇄 또는 시알산 변화가 혈전지혈 기능에 어떠한 생병리적 영향을 미치는지에 대한 앞으로의 많은 연구 주제들을 제시하고 있다.