자동혈액응고분석기 Sysmex CS-5100을 이용한 Antithrombin, Protein C, Free Protein S 검사의 수행능 평가
Performance Evaluation of Innovance Antithrombin, Berichrom Protein C and Innovance Free Protein S Assays Using the Automated Coagulation Analyzer Sysmex CS-5100
Article information
Trans Abstract
Purpose
Antithrombin, protein C, and protein S are natural anticoagulants. Their deficiencies are associated with an increased risk of venous thromboembolism. The aim of this study was to evaluate the performances of Innovance Antithrombin, Berichrom Protein C, and Innovance Free Protein S reagents using the automated coagulation analyzer Sysmex CS-5100.
Methods
Innovance Antithrombin, Berichrom Protein C, and Innovance Free Protein S reagents were evaluated for their precision, linearity, and reference ranges and compared to the HemosIL Liquid Antithrombin, HemosIL Protein C, and the HemosIL Free Protein S reagents using ACL TOP 700, respectively, following the Clinical and Laboratory Standards Institute guidelines.
Results
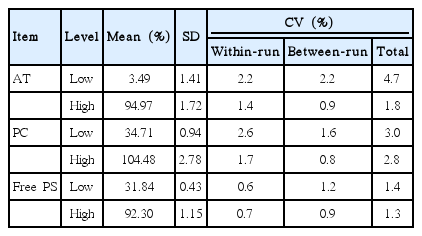
The within-run, between-run, and total coefficients of variation (CV) for Innovance Antithrombin assay were 2.2%, 2.1%, and 4.7% at the low level and 1.4%, 0.9%, and 1.8% at the high level, respectively. For Berichrom Protein C assay, the values were 2.6%, 1.6%, and 3.0% at the low level and 1.7%, 0.8%, and 2.8% at the high level, respectively. For Innovance Free Protein S assay, the values were 0.6%, 1.2%, and 1.4% at the low level and 0.7%, 0.9%, and 1.3% at the high level, respectively. The linearities for Innovance Antithrombin, Berichrom Protein C, and Innovance Free Protein S were in the ranges of 1.8- 149.8%, 0.4-147.9%, and 6.6-139.4%, respectively. In method comparison between ACL-TOP 700 and CS-5100 for each test item, there existed systematic and/or proportional biases.
Conclusion
Clinical use of each assay is considered useful in detecting corresponding protein deficiency.
서론
항트롬빈(antithrombin III), C단백(protein C), S단백(protein S)은 모두 간에서 합성되는 비타민 K-의존 자연항응고제(natural anticoagulant)로서 선천적이든 후천적이든 결핍 시 혈전성향을 보일 수 있다. 이들 단백이 결핍되면 임상적으로 주로 심부정맥혈전증(deep vein thrombosis, DVT) 또는 폐색전증(pulmonary embolism, PE)이 발생할 수 있다. 서양에서 C단백 결핍은 200-500명 중 1명, S단백 결핍은 500명 중 1명, 항트롬빈 결핍은 2,000-5,000명 중 1명 정도로 보고된다. 항트롬빈 결핍이 가장 드물지만 환자의 50% 정도까지에서 일생 중 혈전을 경험하게 된다[1].
항트롬빈은 432개의 아미노산으로 이루어진 비타민 K-의존 당단백으로서 3개의 이황화결합을 가지고 있으며 4개의 당화(glycosylation) 부위가 있다. 주된 형태인 α-트롬빈은 4개의 당화부위가 모두 올리고당(oligosaccharide)과 결합되어 있다. 항트롬빈은 혈액응고계에서 주로 FIIa와 FXa를 억제하지만 FVIIa, FIXa, FXIa 등도 억제한다. 특히, 헤파린이 있으면 2,000-4,000배 정도 그 억제 반응이 증강된다. C단백은 경쇄와 중쇄가 이황화결합으로 연결되어 이루어진 비타민 K-의존 당단백이다[3].
혈액 내의 C단백은 트롬빈이 내피세포 표면의 트롬보모듈린에 결합하면 활성화된다. 활성화 C단백은 인지질, 칼슘, S단백의 도움을 받아 FVa와 FVIIIa을 불활성화시킴으로써 응고계를 조절하는 역할을 한다[3]. 단백 S는 635개의 아미노산으로 이루어진 비타민 K 의존 당단백으로 단백 C의 인지질에 대한 친화력을 증강시켜 FVa와 FVIIIa를 불활성화시켜 혈액응고를 억제하는 보조인자로 작용한다. 혈중 단백 S의 약 60%는 C4b-결합단백(C4b-binding protein, C4b-BP)과 결합하여 존재하고 나머지 40% 정도만 유리형으로 존재하는데 단백 C의 보조인자로서의 역할은 유리형이 가지고 있다) [4].
항트롬빈, C단백, S단백의 정확한 측정은 정맥혈전색전증 환자들을 진단하고 평가하는 데 도움이 된다. 이 연구에서는 항트롬빈, C단백, 유리형 S단백 측정시약들(Innovance Antithrombin, Berichrom Protein C and Innovance Free Protein S)의 검사수행능을 평가해 보고자 하였다.
방법
기기 및 시약
항트롬빈, C단백, 유리형 S단백을 측정하기 위해서 각각 INNOVANCE Antithrombin, Berichrom Protein C, INNOVANCE Free Protein S Ag (Siemens Healthcarecare Diagnostics, Marburg, Germany) 시약과 Sysmex CS-5100 (Sysmex Corporation, Kobe, Japan) 자동혈액응고분석기를 사용하였다. 또한, 비교 평가를 위해서 각각 HemsIL Liquid Antithrombin, HemosIL Protein C, HemosIL Free Protein S (Instrumentation Laboratory, Lexington, MA, USA) 시약과 ACL-TOP 700CTS (Instrumentation Laboratory) 자동혈액응고분석기를 이용하였다. INNOVANCE Antithrombin 시약은 혈장 내의 기능적으로 활성이 있는 항트롬빈을 정량적으로 측정한다. 과량의 FXa를 일정량의 검체(혈장)에 넣어주면, 헤파린 존재하에 일부 FXa는 혈장 내의 항트롬빈과 복합체를 이루어 불활성화된다. 불활성화되지 않고 남아있는 FXa는 특이 발색기질(chromogenic substrate)과 반응하여 발색을 일으키고 405 nm에서 흡광도가 증가하게 된다. 활성이 있는 항트롬빈의 양이 적을수록 발색반응은 증가한다. Berichrom Protein C 시약은 혈장 내의 기능적으로 활성이 있는 C단백을 정량적으로 측정한다. 검체(혈장) 내의 C단백을 특정 뱀독으로 활성화시키고, 이때 활성화된 C단백은 특이 발색기질(chromogenic substrate)과 반응하여 발색을 일으키고 405 nm에서 흡광도가 증가하게 된다. INNOVANCE Free Protein S Ag 시약은 혈장 내의 유리형 S단백 항원을 면역혼탁법으로 정량한다. 유리형 S단백에 특이적인 두 가지의 다른 단클론항체로 코팅된 라텍스시약은 검체(혈장) 내의 유리형 S단백과 혼합되면 응집되고, 이때 응집의 정도는 혈장 내의 유리형 S단백 농도와 비례해서 증가한다.
검체
검체는 Clinical and laboratory standards institute (CLSI) H21-A5 지침[5]에 따라 3.2% 구연산나트륨 진공채혈관(Becton Dick¬inson Ltd, Franklin Lakes, NJ, USA)에 채혈하였다. 원심분리(10분, 2,500 g)를 통해 혈소판결핍혈장을 얻어서 실온에서 보관하였고 2시간 이내에 검사를 시행하였다. 2시간 이내에 검사를 할 수 없는 경우에는 -70°C에 검체를 보관하였다. 이후 검사 시에는 37°C에서 해동하고 잘 섞은 후 2시간 이내에 검사를 시행하였다.
정밀도 평가
CLSI EP5-A2 지침[6]에 따라 수행하였으며 항트롬빈, C단백, 유리형 S단백 각각에 대해서 제조사에서 제공하는 저농도 및 고농도의 정도관리 물질을 사용하였다. 정밀도 평가를 위해 동일한 검체를 하루 2회(최소 4시간 간격), 1회 2번씩 5일간 측정하여 평균, 표준편차, 변이계수 등을 산출하였다.
직선성 평가
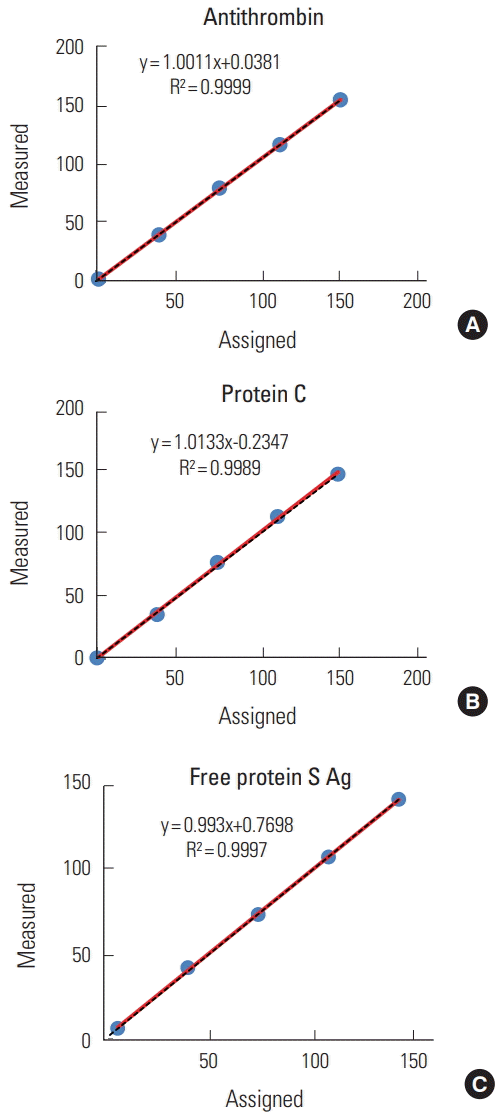
CLSI EP6-A 지침[7]에 따라 수행하였으며 측정값이 높은 환자검체를 희석하여 제조사에서 제공한 측정가능범위를 평가하였다. 항트롬빈, C단백, 유리형 S단백 각각에 대해서 고농도의 측정값이 149.8%, 147.9%, 139.4%인 혼합혈장과 저농도의 측정값이 1.8%, 0.4%, 6.6%인 혼합혈장을 4:0, 3:1, 2:2, 1:3, 0:4 비율로 섞어서 평가하였으며 최적의 다항식이 일차선형인 경우 해당범위에서 직선성이 유지되는 것으로 판정하였다.
참고범위검증
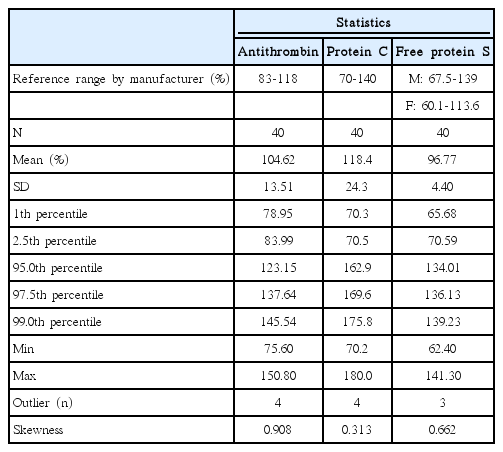
PT, aPTT, 일반화학검사, CBC 검사결과가 정상인 건강인 40명의 검체를 이용하여 제조사에서 제공하는 참고범위를 검증하였다.
비교평가
CLSI EP9-A2 지침[8]에 따라 위의 기기 및 시약에서 기술한 바와 같이 항트롬빈, C단백, 유리형 S단백 각각에 대해서 ACL-TOP 700CTS (Instrumentation Laboratory)와 Sysmex CS-5100 (Sysmex Corporation) 자동혈액응고분석기를 이용하여 검사하고 그 결과값을 비교, 분석하였다. 각 항목별로 임상적으로 중요한 농도범위가 포함되도록 120명의 혈장검체를 이용하였다. 비교평가를 위해 사용된 검체는 처방 후 검사실에서 검사를 하고 남은 잔여검체를 이용하였다.
결과
정밀도
항트롬빈, C단백, 유리형 S단백 검사들의 평균, 표준편차, 검사 내(withinrun) 변이계수, 검사수행 간(between-run) 변이계수, 총변이계수는 Table 1과 같다.
직선성
항트롬빈, C단백, 유리형 S단백 검사항목들에 대해서 희석한 각 5개 검체들의 측정값은 각각 1.8-149.8%, 0.4-147.9%, 6.6-139.4% 범위를 보이며 최적의 다항식이 일차선형으로 회귀방정식의 상관계수가 각각 0.999, 0.998, 0.999로 직선성을 유지하였다(Fig. 1).
참고범위
제조사에서 제공한 참고범위를 검증하기 위하여 건강한 성인 40명의 검체를 사용하여 항트롬빈, C단백, 유리형 S단백을 측정하고 평균, 표준편차, 최솟값, 최댓값 등을 산출하였다. 그 결과는 Table 2와 같다.
상관성 평가
항트롬빈(n=129), C단백(n=130), 유리형 S단백(n=130) 검사항목들에 대해서 Sysmex CS-5100 (Sysmex Corporation) 응고분석기에서 측정한 검사값은 각각 평균 77.3%, 100.4%, 85.0%이었고 표준편차 25.3%, 29.0%, 22.7%이었다. 이들 검사항목들에 대해서 ACL-TOP 700 (Instrumentation Laboratory) 응고분석기에서 측정한 검사값은 각각 평균 76.9%, 94.6%, 75.9%이었고 표준편차 28.5%, 29.2%, 22.1%이었다.
통계
통계처리를 위해 Microsoft Office Excel 2016 (Microsoft Corporation, Redmond, WA, USA), Analyse-it v3.90.7 (Analyse-it Software, Ltd. Leeds, United Kingdom), SPSS v18.0 (SPSS Inc., Chicago, IL, USA) 등의 프로그램을 이용하였다. 상관성 평가를 위해 Passing-Bablok 회귀분석과 Bland-Altman plot을 사용하였고 검사의 유의수준(P-value)이 0.05 미만일 때 통계학적으로 유의하다고 판단하였다.
고찰
지혈은 트롬빈 활성화를 통한 섬유소응괴 형성과 항트롬빈, C단백, S단백 등의 자연항응고제의 활성을 통한 조절과정으로 이루어져 있다. 이들 단백의 측정은 기능(활성도)과 항원량 검사로 구분된다. 항트롬빈과 C단백 결핍의 선별은 기능검사로 하고 S단백 결핍의 선별은 유리형 S단백 항원량 검사로 한다. 현재 항트롬빈과 C단백 기능검사는 응고시간을 기반으로 한 방법보다는 각각에 특이적인 발색기질(chromogenic substrate)을 이용한 방법을 주로 사용한다. S단백 검사는 특이적 발색기질의 부재로 그 활성도를 C단백 존재하에 프로트롬빈시간(prothrombin time)이 지연되는 정도로 측정하기도 하지만 응고시간을 바탕으로 한 S단백 활성도 검사는 그 측정값이 여러가지 요인에 의해 영향을 많이 받는다. 따라서 최근에는 유리형 S단백 항원량을 선별검사로 주로 이용한다[9]. 이에 이들 세 가지(INNOVANCE Antithrombin, Berichrom Protein C, INNOVANCE Free Protein S Ag) 검사 시약을 평가해 보았다.
INNOVANCE Antithrombin, Berichrom Protein C, INNOVANCE Free Protein S Ag의 세 가지 시약을 사용하여 각각 저농도와 고농도의 두 가지 정도관리 물질에서 시행한 검사 결과를 통해서 검사 내 변이계수, 검사수행 간 변이계수, 총변이계수가 모두 5% 이하로 우수한 정밀도를 보여주었다(Table 1). 또한 저농도와 고농도의 혼합혈장을 섞어서 만든 5가지 농도의 물질들을 이용하여 검사한 결과 직선성에서도 우수함을 보여 주었다(Fig. 1).
건강한 성인 40명의 검체로 항트롬빈, C단백, 유리형 S단백 항원 검사를 시행한 결과, 제조사에서 제공한 참고범위를 벗어난 수는 각각 4, 4, 3개로 제공된 참고범위가 검증되었다(Table 2).
비교평가를 통해서 평가의 대상이 된 세 가지 시약(INNOVANCE Antithrombin, Berichrom Protein C, INNOVANCE Free Protein S Ag)은 비교 대상인 세 가지 시약(HemosIL Liquid Antithrombin, HemosIL Protein C, HemosIL Free Protein S)과 모두 차이가 있음을 알 수 있었다(Fig. 2). 항트롬빈 활성도 검사는 ACL TOP700과 CS-5100을 이용한 방법의 비교에서 systematic bias와 proportional bias가 존재하였다(95% CI of intercept, 5.451-14.23; 95% CI of slope, 0.8250-0.9357). 특히, 참고범위 이하의 경우에 INNOVANCE Antithrombin 시약이 HemosIL Liquid Antithrombin 시약에 비해서 측정값이 다소 높음을 알 수 있었다(Fig. 2A and A´). C단백 활성도 검사는 ACL TOP700과 CS-5100을 이용한 방법의 비교에서 systematic bias가 존재하였다(95% CI of intercept, 3.444-8.928; 95% CI of slope, 0.9545-1.013). Berichrom Protein C 시약은 HemosIL Protein C 시약에 비해서 측정값이 평균 5.9% 더 높았다(Fig. 2B and B´). 항트롬빈 활성도와 C단백 활성도 검사는 각각 두 가지 시약 모두 측정 원리가 동일하다. 따라서, 측정값의 차이는 각 제조사의 시약 특성으로 인한다고 밖에는 설명할 수가 없을 것 같다.
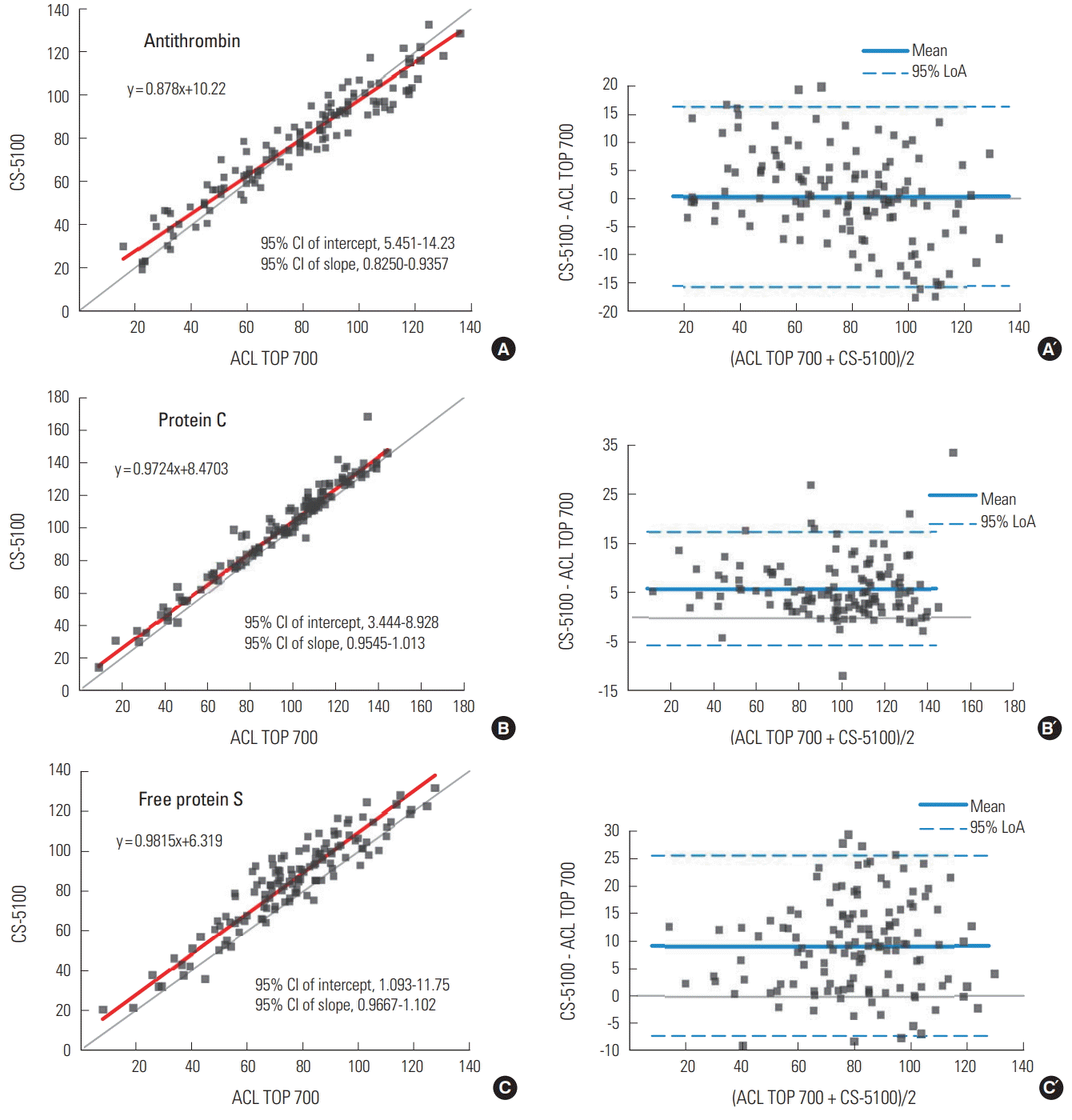
Comparison between the results by ACL TOP700 and CS-5100 coagulation analyzers. Passing-Bablok regression (A, B, and C) and Bland-Altman plot (A’, B’, and C’). Red line represents the fitted regression equation, and grey line represents the identity line. LoA represents limit of agreement.
유리형S단백 항원량 검사는 ACL TOP700과 CS-5100을 이용한 방법의 비교에서 proportional bias가 존재하였다(95% CI of intercept, 1.093-11.75; 95% CI of slope, 0.9667-1.102). INNOVANCE Free Protein S Ag 시약은 HemosIL Free Protein S 시약에 비해서 평균 9.1% 더 높은 측정값을 보였다(Fig. 2C and C´). 항트롬빈 활성도와 C단백 활성도 검사 시약들은 측정 원리가 동일한 반면, S단백을 측정하는 시약은 측정 원리에 차이가 있다. HemosIL Free Protein S는 측정과정에서 라텍스에 흡착되어 있는 C4b-BP이 혈장 내의 유리형 S단백과 먼저 결합한 후 S단백에 대한 단클론항체가 코팅되어 있는 두 번째 라텍스시약과 반응시키게되는 반면, Innovance Free Protein S는 S단백에 특이적인 두 가지 서로 다른 단클론 항체로 코팅된 라텍스시약을 사용한다[10]. 이러한 차이는 Innovance 시약이 HemosIL 시약보다 측정값이 높은 원인이 될 수도 있을 것이다.
항트롬빈 활성, C단백 활성, 유리형 S단백 항원을 측정하는 INNOVANCE Antithrombin, Berichrom Protein C, INNOVANCE Free Protein S Ag (Siemens Healthcarecare) 시약들은 우수한 정밀도와 직선성을 보여 주었으며, 비교 대상이 된 시약(HemosIL)과의 일치도에는 다소 차이를 보였다. 환자의 임상적 상황을 고려해서 사용하면 상기의 시약들은 항트롬빈, C단백, S단백의 결핍을 진단하는 데 도움이 될 것이라고 생각한다.